Wat is merkelcelcarcinoom?
Merkelcelcarcinoom is een zeer agressieve vorm van huidkanker die meestal voorkomt in de vorm van een huidkleurig, of blauwrood of paarsrood knobbeltje. Meestal verschijnt het op de huid van het gezicht, het hoofd, de nek, of minder vaak op armen en benen. Maar het kan overal voorkomen. Normale merkelcellen zijn huidcellen die gelinkt worden aan de tastzin. Ze leenden hun naam aan de kankercellen die eruit voortkomen. Deze normale, niet-kankermerkelcellen werden eerst beschreven in 1875 door de Duitse arts Friedrich Sigmund Merkel (Ramahi, et al., 2013).
De incidentie van merkelcelcarcinoom varieert naargelang de regio. Volgens de RARECARE-databank kende Europa tussen 1995 en 2002 een incidentie van 0,13 gevallen per 100.000 inwoners. De incidentie van merkercelcarcinoom is inderdaad verdrievoudigd tussen 1986 en 2001. Het komt ongeveer veertig keer minder vaak voor dan de betrekkelijk zeldzame, maar meer bekende tumor, kwaadaardig melanoom. Mannen worden er iets vaker door getroffen dan vrouwen, meestal op een leeftijd tussen 60 en 80 jaar, en vooral mensen met een lichte huid. (Schadendorf, et all., 2017).
Het risico op merkelcelcarcinoom wordt verhoogd door langdurige blootstelling aan de zon en stoornissen van het immuunsysteem veroorzaakt door leeftijd, ziekte of immunosuppressieve geneesmiddelen. Langdurige blootstelling aan de zon blijkt een belangrijke rol te spelen in ongeveer 20% van de gevallen. Het merkelcelpolyomavirus dat zich manifesteert in de merkelcellen is verantwoordelijk voor de rest van de gevallen, waarschijnlijk hierbij ‘geholpen’ door blootstelling aan de zon. Het virus is echter bij de meeste mensen aanwezig in een niet-agressieve vorm die geen problemen veroorzaakt (Ramahi, et al., 2013).
Als merkelcelcarcinoom vroegtijdig ontdekt wordt en snel behandeld wordt, chirurgisch of met radiotherapie, is genezing mogelijk. Maar meestal is het een zeer agressieve en zich snel verspreidende tumor, met een grote kans op terugkeer, lokaal of op grotere afstand. Daarom is het cruciaal hem vroeg te ontdekken en te verwijderen. Mensen met een merkelcelcarcinoom met een diameter kleiner dan 2 cm, dat niet is uitgezaaid naar de regionale lymfeklieren, hebben een vijfjarig overlevingspercentage van 76 procent. Mensen met een merkelcelcarcinoom dat regionaal is uitgezaaid naar n enkele lymfeklier hebben een vijfjarig overlevingspercentage van 50 procent. Als het carcinoom verder is uitgezaaid naar meerdere lymfeklieren, is het overlevingspercentage lager (Iyer J, et al., 2014).
Sensory Receptors in Skin

Wat is de oorzaak van merkelcelcarcinoom?
Merkelcelpolyomavirus is een virus dat voorkomt in ongeveer 80 procent van de merkelcelcarcinoomtumoren. Voor ze twintig zijn, werden de meeste mensen echter al zonder gevolg blootgesteld aan het virus. Uitzonderlijk besmet het virus de cel en produceert een protene waardoor de cel ongecontroleerd uitgroeit tot een tumor. Maar dat het virus in 20 procent van de merkelceltumoren niet voorkomt, toont aan dat de ziekte zich ook kan ontwikkelen zonder het virus. Het is mogelijk dat als iemand besmet is met het merkelcelpolyomavirus, er nog andere factoren, zoals een aangetast immuunsysteem of blootstelling aan de zon, nodig zijn vooraleer de tumorr kan groeien. Vele mensen kunnen hun leven lang drager zijn van het merkelcelpolyomavirus zonder dat zich ooit een merkelcelcarcinoom ontwikkelt (Ramahi, et al., 2013).
Process of Cancer Cell Development

Een verzwakt immuunsysteem en merkelcelcarcinoom gaan meestal samen. Mensen bij wie het immuunsysteem chronisch onderdrukt wordt (zoals HIV-patinten of patinten die een orgaantransplantatie hebben ondergaan en immunosuppressieve medicijnen moeten slikken) hebben 15 keer meer kans merkelcelcarcinoom te ontwikkelen dan zij van wie het immuunsysteem niet is aangetast. Omdat het immuunsysteem niet enkel preventief optreedt tegen het merkelcelcarcinoom, maar ook helpt bij het tegengaan van de verspreiding van de kankercellen, hebben dergelijke patinten twee keer meer kans om te sterven dan mensen met een volledig functioneel immuunsysteem (Ramahi, et al., 2013).
Merkelcelcarcinoom heeft ook een sterke link met blootstelling aan de zon. Er bestaat ook een sterk verband tussen de tumor en de aanwezigheid van plaveiselcelcarcinoom en basaalcelcarcinoom, die meestal veroorzaakt of bevorderd worden door blootstelling aan de zon. Blootstelling aan UV en het vrijkomen van vrije radicalen vormen een dubbele bedreiging: niet enkel wordt de huid beschadigd en verhoogt de kans op huidkanker, maar ook wordt het immuunsysteem onderdrukt. Hierdoor vermindert het vermogen van het immuunsysteem om de huid te herstellen, en om tumoren en andere aandoeningen in een vroeg stadium te herkennen en te bestrijden. (Ramahi, et al., 2013).

Risicofactoren en waarschuwingssignalen van merkelcelcarcinoom
Tot de belangrijkste risicofactoren van merkelcelcarcinoom behoren:
- Blootstelling aan het merkelcelpolyomavirus
- Blootstelling aan ultravioletstralen van de zon of een zonnebank
- Verzwakte immuunfunctie, bijvoorbeeld patinten die een immunosuppressieve behandeling volgen
- Lichte huidskleur
- Ouder dan 50 jaar (Ramahi, et al., 2013)
Als merkelcelcarcinoom vroegtijdig ontdekt wordt en snel behandeld wordt, is genezing mogelijk. Maar meestal is het een zeer agressieve en zich snel verspreidende tumor. Daarom is het zeer belangrijk hem vroeg te ontdekken en te verwijderen. De tumoren verschijnen meestal eerst als vaste, niet-pijnlijke letsels of knobbels, vaak op het hoofd, in de nek, en minder vaak op benen en armen. Maar ook de rest van het lichaam is er vatbaar voor. De knobbels hebben zijn meestal rood, roze, blauw, violet van kleur of zijn huidkleurig. Hun grootte varieert. Meestal hebben ze bij ontdekking een diameter die kleiner is dan 2 cm (Ramahi, et al., 2013).

Het is essentieel om de huid regelmatig te onderzoeken op nieuwe of veranderende vlekken, om huidkanker in een vroeg stadium te ontdekken. Vooral als de vlek zich in slechts enkele weken ontwikkelt, maar ook als de nieuwe vlek of de verandering beperkt is. Het zorgvuldig controleren van de huid is zeker van belang voor mensen die reeds een merkelcelcarcinoom, een basaalcelcarcinoom of een melanoom hebben gehad. Besteed vooral aandacht aan plaatsen die vroeger reeds behandeld werden. Vraag je arts onmiddellijk een verdachte vlek te onderzoeken.
Sommige dokters gebruiken het volgende acroniem “AEIOU” om de combinatie van risicofactoren en waarschuwingssignalen samen te vatten:
A: Asymptomatisch (geen pijn of gevoeligheid)
E: Expanderend (snel)
I: Immuunsuppressie
O: Ouder dan 50 jaar
U: UV-blootstelling van lichte huid (Ramahi, et al., 2013)
Stadia van het merkelcelcarcinoom
Er zullen een aantal tests worden uitgevoerd om de ernst van de ziekte te bepalen, en de mate waarin ze zich mogelijk al heeft verspreid. Patiënten waarbij het merkelcelcarcinoom zich nog niet lijkt te hebben verspreid (uitzaaiingen/metastasen) kunnen mogelijk een biopsie van de poortwachterklier (of schildwachtklier) ondergaan, om te bevestigen dat het carcinoom niet is uitgezaaid naar de lokale lymfeklieren. De biopsie is minimaal-invasief, met een laag risico op bijwerkingen, en is zeer belangrijk voor het bepalen van de prognose op lange termijn. Eens de kankercellen namelijk de lymfeklieren bereiken, komen ze gemakkelijk in de bloedbaan terecht en kunnen ze zich doorheen heel het lichaam verspreiden. Beeldvorming van het volledige lichaam zoals CT- en/of PET-scan kunnen ook uitgevoerd worden, op zoek naar gemetastaseerde tumoren. Patiënten waarbij uitzaaiingen worden vermoed, kunnen een ‘fijne naald aspiratiecytologie’ ondergaan om de aanwezigheid van merkelcelcarcinoom in andere organen te bevestigen (Ramahi, et al., 2013).
Wat gebeurt tijdens een biopsie van de poortwachterklier?
Bij de uitvoering van een biopsie van de poortwachterklier, gebruikt het medische team de techniek lymphatic mapping. om de poortwachterklieren te lokaliseren. Vervolgens wordt een radioactieve merkstof en/of een blauwe kleurstof ter hoogte van de tumor ingespoten. Het team volgt de tracer en de vloeistof naar de zone waarin zich de eerste drainerende lymfeklier bevindt. Een instrument dat de tracer detecteert, registreert het pad van de tumor naar de poortwachterklieren. De meeste kankercellen die zich vanuit de tumor verspreiden, volgen hetzelfde pad.
De chirurg verwijdert vervolgens de poortwachterklieren. In een pathologielaboratorium onderzoekt een expert-patholoog de lymfeklieren onder een microscoop, op zoek naar kankercellen.
Als de biopsie de aanwezigheid van kankercellen aantoont, verwijdert de chirurg alle lokale klieren uit de zone. In de meeste gevallen worden ze ook vernietigd met behulp van bestralingen (Kermani, et al, 2016).
Voordelen van een biopsie van de poortwachterklier
Het staat nog niet vast dat biopsie van de poortwachterklier, gevolgd door verwijdering van alle lymfeklieren in de lokale zone indien de biopsie wijst op kanker, de overlevingsduur verlengt. In theorie zou dit wel het geval moeten zijn. Omdat kankercellen bij ongeveer een op drie mensen met merkelcelcarcinoom de lymfeklieren bereiken, en omdat ze vaak niet opgemerkt worden tijdens een eerste lichamelijk onderzoek, raden de artsen de techniek nog routinematig aan (Ramahi, et al., 2013). Een bijkomend voordeel van een biopsie van de poortwachterklier is mogelijk het vermijden van het systematisch verwijderen van lymfeklieren. Door verwijdering van de lymfeklieren vergroot het risico op infectie en opzwellen van armen en benen.
Stadia van het merkelcelcarcinoom
Nadat hij de biopsie van de oorspronkelijke tumor, de biopsie van de poortwachterklier en andere testen (zoals beeldvormings- en bloedtesten) heeft uitgevoerd, zal de arts het stadium van de ziekte bepalen. Het stadium geeft aan hoever de tumor gevorderd en uitgezaaid is.
De keuze van behandeling is afhankelijk van het stadium van de tumor. Er bestaat geen algemeen aanvaard systeem voor indeling in stadia van merkelcelcarcinoom, maar het meestgebruikte systeem is het American Joint Committee on Cancer TNM system (Edge, et al., 2010). Hierbij staat T voor de grootte en de infiltratiediepte in de huidlagen van de primaire (originele) tumor, N geeft de verspreiding aan naar de lokale ‘lymph nodes’ (lymfeklieren; N geeft ook aan in hoeverre de lymfeklieren al aangetast zijn) en M is een aanduiding voor verre metastasen (uitzaaiingen naar ‘verre organen’, voorbij de lokale lymfeklieren).
Het American Joint Committee on Cancer system beschrijft vijf stadia:
- Stadium 0: In situ tumoren (oppervlakkige tumoren die nog niet zijn doorgedrongen tot voorbij de epidermis, de buitenste laag van de huid)
- Stadium I en stadium II: de tumoren hebben de lokale lymfeklieren nog niet bereikt, met in stadium I relatief kleine tumoren met laag risico en in stadium II grotere tumoren met een hoger risico.
- Stadium III: tumoren hebben nu de lymfeklieren bereikt maar zijn nog niet verder uitgezaaid.
- Stadium IV: uitzaaiingen over grotere afstand, tumoren waarvan de kankercellen zich hebben verspreid voorbij de lymfeklieren, en op grotere afstand gelegen organen hebben bereikt.
Elk stadium wordt dan nauwkeuriger onderverdeeld, van kleinste naar grootste risico, afhankelijk van de variabele eigenschappen van de primaire tumor, en uitzaaiingen naar de klieren en/of verre metastasen. Raadpleeg voor meer details de American Joint Committee on Cancer Staging Manual.

Behandeling van merkelcelcarcinoom
Behandeling van merkelcelcarcinoom is vooral gebaseerd op het stadium van de ziekte en de algemene gezondheidstoestand van de patiënt. Tot op heden bestonden de belangrijkste behandelingen van merkelcelcarcinoom uit chirurgische excisie, bestraling en chemotherapie (Schadendorf, et all., 2017).
Het wordt aanbevolen de primaire (oorspronkelijke) tumor door middel van chirurgische excisie volledig te verwijderen wanneer de diagnose werd gesteld van een merkelcencarcinoom in een lokaal stadium (stadia I en II). Dit wordt gevolgd door een verificatie. Indien het risico op terugkeer of uitzaaiing naar de lymfeklieren groot is (te wijten aan factoren zoals een grote primaire tumor, onvolledige excisie of een persoon met een verzwakt immuunsysteem), zal de dokter na de chirurgische excisie meestal aanraden de lymfeklieren te verwijderen en vervolgens het letsel te bestralen. Sommige dokters raden bestralingen aan voor alle patiënten met merkelcelcarcinoom. Met bestraling kan men alle kankercellen vernietigen die men via een lichamelijk onderzoek niet ontdekt. Bovendien kan bestraling helpen bij het voorkomen van de terugkeer of de uitzaaiing van de tumor naar de lokale lymfeklieren, of verder. Merkelcelcarcinoom reageert zeer goed op bestraling als aanvullende therapie (Schadendorf, et all., 2017).
Indien de tumor een lymfeklier aantast (stadium III), zullen de artsen meestal niet enkel de primaire (originele) tumor verwijderen, maar zullen ze ook alle lymfeklieren in dezelfde zone verwijderen en bestralen. Hierdoor verminderen ze het risico op terugkeer en voorkomen ze mogelijk verre uitzaaiingen. In de meeste gevallen komen patiënten met merkelcelcarcinoom en kennelijk zonder ziekte van de lymfeklieren, in aanmerking voor een poortwachterklierbiopsie. Aan de hand hiervan tracht men vast te stellen of de kankercellen de zone van de lokale lymfeklieren reeds bereikt hebben. Op het moment van de diagnose hebben merkelcelcarcinomen de nabijgelegen lymfeklieren meestal al bereikt, of achter zich gelaten, ongeacht of de lymfeklieren al dan niet vergroot zijn, of ontdekt kunnen worden bij een lichamelijk onderzoek (Schadendorf, et all., 2017).

Als de tumor zich heeft verspreid over een grotere afstand, zoals naar longen of lever, zullen dokters mogelijk ook aanvullende chemotherapie aanbevelen voor patinten met merkelcelcarcinoom. Met wisselend (maar vaak beperkt) succes werden verschillende therapien gebruikt voor merkelcelcarcinoom in een gevorderd stadium. Spijtig genoeg treden vaak ernstige bijwerkingen op. Er bestaan geen gecontroleerde klinische studies die hebben aangetoond dat chemotherapien de overlevingsduur verlengen. Sommige zorgen er vaak wel voor dat de tumor kortstondig krimpt. Maar artsen gebruiken chemotherapie niet altijd om de overlevingsduur te verlengen maar wel om de levenskwaliteit te verbeteren door de pijn te verminderen, en comfort en mobiliteit te vergroten (Schadendorf, et all., 2017).
Het meest recente klinische onderzoek hieromtrent heeft zich toegespitst op het vermogen van het immuunsysteem om de merkelkankercellen aan te vallen. Vooral de eerste studies van “checkpoint inhibitor” -immunotherapieën zijn veelbelovend. Deze blokkeren bepaalde moleculaire receptoren die de activering van witte bloedcellen verhinderen waardoor ze mogelijk gevaarlijke ontstekings- of auto-immuunreacties voorkomen. Kankercellen kunnen deze blokkering ook gebruiken om te vermijden dat ze worden aangevallen door het immuunsysteem. Blokkeren van deze receptoren, die als “remmen” van het immuunsysteem werken, kan een activering van de witte bloedcellen teweegbrengen, die dan de tumor kunnen bestrijden.
En klasse van veelbelovende therapien blokkeert een immuniteitremmende receptor ‘programmed death-1 (PD-1)’. Deze therapien stimuleren de activering van de witte bloedcellen zodat ze de kankercellen aanvallen. Een andere therapie met controlepuntblokkering die uitgetest wordt op patinten met merkelcelcarcinoom blokkeert ‘programmed death-ligand 1 (PD-L1)’, een molecule die zich bindt aan PD-1 op tumorcellen. Zo wordt een complex gevormd dat de activering van witte bloedcellen verhindert en het immuunsysteem onderdrukt. Deze behandelingen blokkeren PD-1 of PD-L1, wat een activering van de witte bloedcellen kan teweegbrengen, die dan op hun beurt de tumor kunnen bestrijden. Deze klasse van behandelingen lijkt veelbelovend voor mensen met merkelcelcarcinoom in een gevorderd stadium (Schadendorf, et all., 2017).
PD-1/PD-L1 Blockade
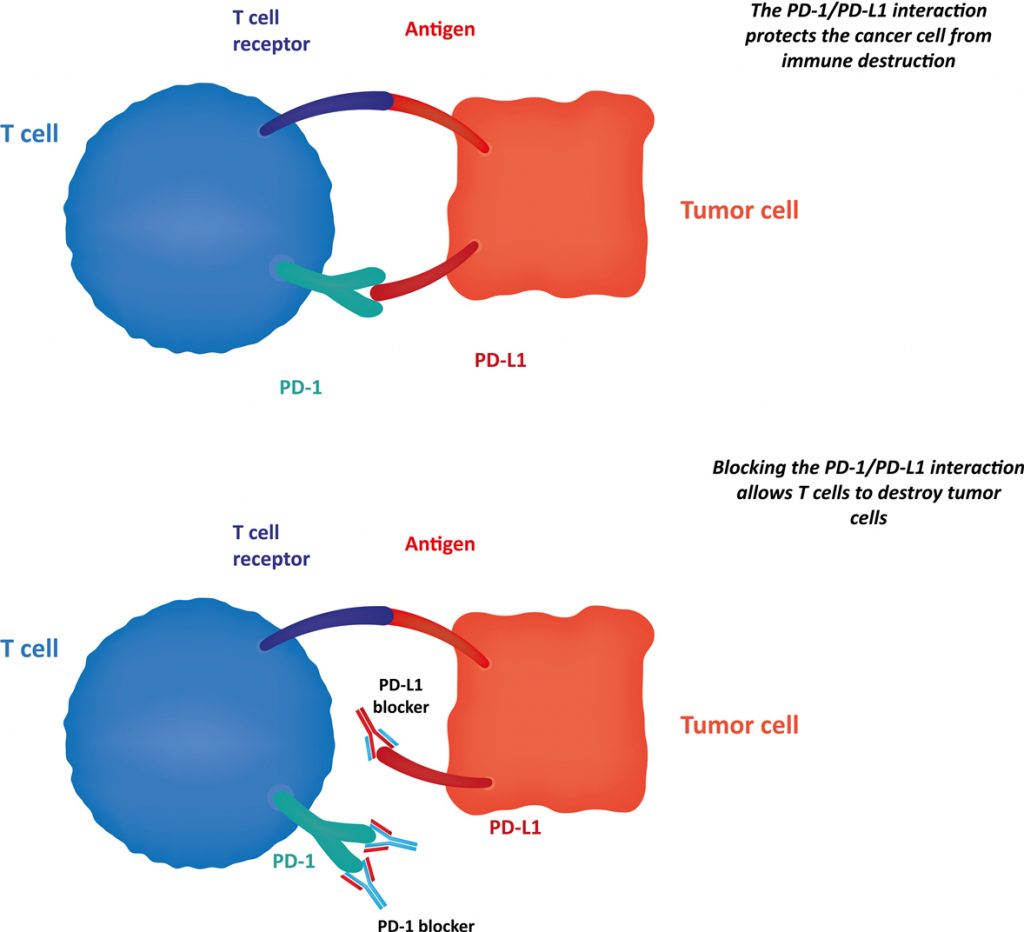
U kan bij uw arts navraag doen over deze en andere klinische testen waarvoor men op zoek is naar patiënten met merkelcelcarcinoom, die bereid zijn nieuwe behandelingen te testen.
Opvolging
Indien u reeds werd behandeld voor merkelcelcarcinoom, dienen u en uw arts uw huid, voor de rest van uw leven, nauwlettend in het oog te houden. Er wordt aangeraden gedurende de eerste drie jaren om de drie of vier maanden een nabehandeling te volgen. Daarna volgt gedurende vijf jaren een nabehandeling om de zes maanden. Naast een huidonderzoek kan uw arts ook beeldvormingstests zoals CT-, PET-scans of echografien uitvoeren.
Uitdagingen in diagnose en behandeling
Diagnose en beheer van merkelcelcarcinoom vormen een uitdaging. Zowel patiënten als artsen kunnen de tumoren eerst aanzien als goedaardige letsels. Foute diagnoses die vaak gesteld worden zijn een cyste of folliculitis (zwellen van ontstoken haarzakjes). Het is belangrijk op te merken dat merkelcelcarcinoom veel zeldzamer is dan goedaardige letsels zoals ontstoken haarzakjes.
In sommige gevallen ontwikkelt het merkelcelcarcinoom zich op een locatie waar het moeilijk ontdekt wordt. Dit vertraagt de diagnose. Ongeveer 5 procent van de merkelcelcarcinomen komt voor in mond, neusholte en keel waardoor ze moeilijk in een vroeg stadium te ontdekken zijn.
Omdat merkelcelcarcinoom een agressieve tumor is, leidt late ontdekking tot late diagnose en behandeling. Hierdoor komt het vaak terug en is het moeilijk met succes te behandelen.
Richtlijnen voor preventie van merkelcelcarcinoom
Een verzwakt immuunsysteem draagt veel bij aan de ontwikkeling en progressie van merkelcelcarcinoom. Het is daarom ook hier belangrijk een gezonde levenshouding aan te nemen zodat de werking van uw immuunsysteem zo efficint mogelijk is. Zo ook is het belangrijk blootstelling aan de zon te vermijden, omdat men denkt dat dit ook bijdraagt aan de ontwikkeling van de ziekte. Dit is nog belangrijker als u of een van uw naaste familieleden merkcelcarcinoom of een andere huidkanker heeft gehad.
e kan jezelf beter beschermen door deze gewoontes op te nemen in je dagelijkse gezondheidszorgroutine:
- Zoek de schaduw op, in het bijzonder tussen 10 en 16 u. tijdens lente, zomer en herfst.
- Vermijd verbranden van de huid door de zon.
- Zonnen om een kleurtje te krijgen is niet nodig. Ga nooit onder de zonnebank.
- Bedek jezelfmet kleding, inclusief een breedgerande hoed en een zonnebril met UV-bescherming.
- Gebruik een breedspectrum (UVA/UVB) zonnebrandcrme met hoge SPF (Sun Protection Factor – beschermingsfactor),elke dag van lente, zomer en herfst, op alle huid die blootgesteld wordt aan de zon. Breng om de paar uur een nieuwe laag aan, zolang je buiten bent.
- Houd pasgeborenen uit de zon zodat ze op langere termijn hiervan geen last ondervinden.Gebruik zonnecrmes op baby’s vanaf de leeftijd van 6 maanden. Houd jongere baby’s helemaal weg uit de zon.
- Onderzoek je huidvolledig, elke maand opnieuw.
- Bezoek jaarlijks je artsvoor een professioneel huidonderzoek.
Mensen die reeds merkelcelcarcinoom gehad hebben, wordt aangeraden gedurende de eerste drie jaren om de drie of vier maanden een nabehandeling te volgen. Daarna volgt gedurende vijf jaren een nabehandeling om de zes maanden.

Referenties
Edge, S.B. & Compton, C.C. The American Joint Committee on Cancer: the 7th Edition of the AJCC Cancer Staging Manual and the Future of TNM. 2010. Ann Surg Oncol 17: 1471.
Iyer J, Storer B, Paulson K, et al. Relationships between primary tumour size, number of involved nodes and survival among 8,044 cases of Merkel cell carcinoma.Journal of the American Academy of Dermatology. 2014;70(4):637-643.
Kermani AT, Rezaei E, Zarifmahmoudi L, Sadeghi R. Lymphatic mapping and sentinel node biopsy in a patient with upper limb Merkel Cell Carcinoma: a case report and brief review of literature. 2016. Nuclear Med Rev 2016; 19, 1: 42–45.
Ramahi E, Choi J, Fuller CD, Eng TY. Merkel Cell Carcinoma. American journal of clinical oncology. 2013;36(3):299-309.
Schadendorf, Dirk et al. Merkel cell carcinoma: Epidemiology, prognosis, therapy and unmet medical needs. European Journal of Cancer, 2017. Volume 71, 53 – 69.
Auteurs
John Hawk, St John’s Institute of Dermatology, Londen, Verenigd Koninkrijk;
Paolo A. Ascierto, Istituto Nazionale Tumori Fondazione, Napels, Italië;
Enrique Grande Pulido, Hospital Universitario Ramon y Cajal, Madrid, Spanje;
Lydia Makaroff, European Cancer Patient Coalition, Brussel, België.
Aangepaste informatie, oorspronkelijk verstrekt door The Skin Cancer Foundation.
Downloads
- Merkel Cell Carcinoma Leaflet (CZ) - (PDF)
- Merkel Cell Carcinoma Leaflet (DA) - (PDF)
- Merkel Cell Carcinoma Leaflet - (PDF)
- Merkel Cell Carcinoma Leaflet (FI) - (PDF)
- Merkel Cell Carcinoma Leaflet (FR) - (PDF)
- Merkel Cell Carcinoma Leaflet (DE) - (PDF)
- Merkel Cell Carcinoma Leaflet (GR) - (PDF)
- Merkel Cell Carcinoma Leaflet (IT) - (PDF)
- Merkel Cell Carcinoma Leaflet (PL) - (PDF)
- Merkel Cell Carcinoma Leaflet (PT) - (PDF)
- Merkel Cell Carcinoma Leaflet (RO) - (PDF)
- Merkel Cell Carcinoma Leaflet (RU) - (PDF)
- Merkel Cell Carcinoma Leaflet (ES) - (PDF)
- Merkel Cell Carcinoma Leaflet (SE) - (PDF)

















